آفلاتوکسین های تولید شده توسط گونه های آسپرژیلوس بسیار سمی، سرطان زا هستند و باعث آلودگی شدید منابع غذایی می شوند که منجر به عواقب جدی برای سلامتی می شود. آلودگی به آفلاتوکسین در مواد غذایی و خوراک، مانند بادام زمینی، ارزن، کنجد، ذرت، گندم، برنج، انجیر، ادویه جات ترشی جات و کاکائو به دلیل عفونت قارچی در شرایط قبل و بعد از برداشت گزارش شده است. مجتمع آزمایشگاه مواد غذایی رادگستر با داشتن دستگاه کروماتوگرافی مایع و همچنین کروماتوگرافی گازی در بخش دستگاهی آزمایشگاه تمامی آزمایشات آفلاتوکسین را به انجام میرساند.
سم آفلاتکسین ، تشخیص و اقدام
علاوه بر این محصولات غذایی، محصولات تجاری مانند کره بادام زمینی، روغن پخت و پز و لوازم آرایشی نیز به آفلاتوکسین آلوده شده اند. حتی غلظت کم آفلاتوکسین برای انسان و دام خطرناک است. شناسایی و تعیین کمیت آفلاتوکسین در غذا و خوراک یک چالش بزرگ برای تضمین ایمنی مواد غذایی است. بنابراین، توسعه روشهای تحلیلی عملی، حساس و قوی برای شناسایی و تعیین کمیت آفلاتوکسینهای موجود در غلظتهای پایین در غذا و خوراک بسیار مهم است.
کروماتوگرافی و تشخیص آفلاتوکسین
روش های کروماتوگرافی و حسگرهای مختلفی برای تشخیص آفلاتوکسین ها استفاده می شود. بررسی فعلی بینشی در مورد منابع آلودگی، وقوع، تکنیکهای تشخیص و مایکوتوکسین پوشانده، علاوه بر استراتژیهای مدیریت آفلاتوکسینها برای اطمینان از ایمنی و امنیت غذایی ارائه میکند.
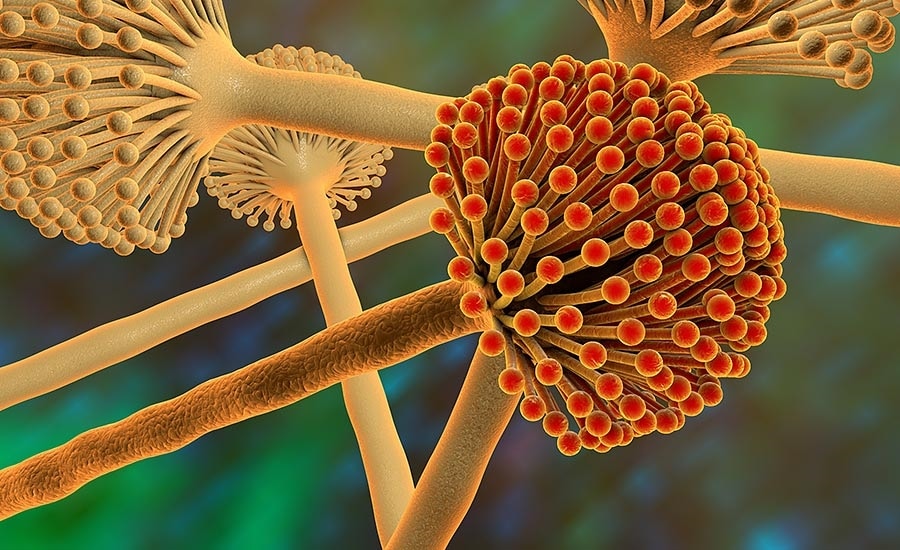 مقدمه ای بر سموم آفلاتوکسین
مقدمه ای بر سموم آفلاتوکسین
ایمنی و امنیت غذایی یکی از مشکلات عمده در شرایط فعلی افزایش جمعیت است. اینها عمدتاً توسط سه جنبه کلیدی تعیین می شوند، (1) در دسترس بودن غذای کافی، (2) دسترسی به غذای سالم و (iii) استفاده از غذا از نظر کیفیت، اهداف تغذیه ای و فرهنگی برای یک زندگی سالم (FAO، 1996). ). شکست هر یک از این جنبه ها منجر به ناامنی غذایی و سوءتغذیه می شود که علاوه بر جنبه اجتماعی-اقتصادی جامعه، سلامت انسان را بیشتر تحت تاثیر قرار می دهد. علاوه بر این، آلودگی غذا و خوراک توسط مایکوتوکسین ها یکی از عوامل کلیدی مسئول ایجاد ناامنی غذایی است (Udomkun et al., 2017).
آفلاتوکسین و سازمان های جهانی
طبق گزارش سازمان غذا و کشاورزی (FAO)، یک چهارم محصولات زراعی جهان تحت تأثیر مایکوتوکسین ها قرار دارد (Wu, 2007؛ Pankaj et al., 2018). سه جنس اصلی قارچ های تولید کننده مایکوتوکسین عبارتند از: آسپرژیلوس، فوزاریوم و پنی سیلیوم (Reddy et al., 2010). در میان انواع مختلف مایکوتوکسین ها، آفلاتوکسین ها (AFs) بسیار سمی هستند .
به عنوان آلوده کننده طیف گسترده ای از مواد غذایی مانند ذرت، بادام زمینی، میوه های خشک، گوشت و محصولات مبتنی بر شیر شناخته شده اند (Mutegi et al., 2009; Perrone et al. ، 2014؛ اقبال و همکاران، 2015). AF توسط گونه های آسپرژیلوس، یعنی A. flavus، A. nomius و A. parasiticus (Payne and Brown، 1998)، علاوه بر تولید آن توسط گونه های دیگر آسپرژیلوس مانند A. astellatus (ریتر و همکاران، 2009) تولید می شود.
این قارچ ها معمولاً در شرایط گرم و مرطوب مناطق گرمسیری و نیمه گرمسیری رشد می کنند (Magan and Aldred, 2007; Battilani et al., 2011). تکنیکهای فرآوری غذا به دلیل ماهیت مقاوم در برابر حرارت، برای از بین بردن AF از مواد غذایی و خوراک آلوده کافی نیست (Medina et al., 2017b).
 تاثیر آفلاتوکسین بر حیوانات و انسانها
تاثیر آفلاتوکسین بر حیوانات و انسانها
بلع AF از غذا و خوراک آلوده منجر به عوارض سلامتی جدی در انسان و حیوانات شده است (Fung and Clark, 2004; Binder et al., 2007; Sherif et al., 2009). بنابراین، کشورهای مختلف مقررات سختگیرانه ای را برای AF در غذا و خوراک برای حفظ سلامت افراد اجرا کرده اند (Juan et al., 2012). حد ایمن AFs در محدوده 4 تا 30 میکروگرم بر کیلوگرم برای مصرف انسان قرار دارد. اتحادیه اروپا سخت ترین سطح استاندارد را با AFB1 و کل AF در هر محصولی که برای مصرف مستقیم در نظر گرفته شده است، به ترتیب از 2 میکروگرم بر کیلوگرم و 4 میکروگرم بر کیلوگرم بیشتر نیست (EC، 2007، 2010).
حد مجاز آفلاتوکسین در استاندارد ها
به طور مشابه، حداکثر حد مجاز تعیین شده برای AF در ایالات متحده 20 میکروگرم بر کیلوگرم است (Wu، 2006). علاوه بر این، فنآوریهای نوآورانه و استراتژیهای کنترلی مختلفی برای مدیریت قبل و پس از برداشت AF به منظور افزایش بهرهوری کشاورزی پایدار اعمال میشوند (پریتو و همکاران، 2015). اگرچه انتشارات متعددی در مورد AF در غذا و خوراک وجود دارد، تازگی و قوت این بررسی در استفاده از روشهای جدید توسعهیافته برای تشخیص AF در غذا و خوراک با ارجاع ویژه به AF ماسکدار است. علاوه بر این، این بررسی همچنین بر روی وقوع، تأثیر تغییرات آب و هوایی همراه با استراتژیهای کنترل AF در غذا و خوراک برای اطمینان از ایمنی و امنیت غذایی برای زندگی سالم و توسعه اجتماعی-اقتصادی متمرکز است.
 بروز آفلاتوکسین در غذا و خوراک
بروز آفلاتوکسین در غذا و خوراک
آفلاتوکسین ها از نظر شیمیایی مشتقات دیفورانوکومارین با یک گروه بی فوران متصل به هسته کومارین و یک حلقه پنتانون (در مورد AFBs) یا یک حلقه لاکتون (در مورد AFGs) هستند (Schuda, 1980). چهار AF اصلی در بین 20 مورد شناسایی شده عبارتند از AFB1، AFB2، AFG1 و AFG2. انواع B توسط A. flavus تولید می شوند در حالی که انواع G توسط A. parasiticus تولید می شوند (Kumar et al., 2017). بیوسنتز AFs شامل 18 مرحله آنزیمی با حداقل 25 ژن است که مسئول تولید آنزیم ها و تنظیم فرآیند بیوسنتزی هستند (Yu et al., 2002; Yabe and Nakajima, 2004).
وقوع AF در انواع مختلف غذا و خوراک رایج است برخی از مواد غذایی و خوراکی که بیشترین تأثیر را دارند شامل بادام زمینی، آجیل، انجیر، ذرت، برنج، ادویه جات ترشی جات و میوه های خشک می شود (Martinez-Miranda et al., 2019). نشان داده شده است که در بین غلات آزمایش شده، 37.6٪ حداقل به هر یک از AF آلوده شده اند (Andrade و Caldas، 2015). اگرچه برنج کالای پرخطری برای آلودگی AF نیست، اما AFB1 علاوه بر سایر مایکوتوکسینها در برنجهای چین، مصر، هند، ایران، مالزی، نپال، پاکستان، فیلیپین، بریتانیا و ایالات متحده شناسایی شده است (Tanaka et al. ، 2007؛ رحمانی و همکاران، 2011؛ لطف الله و حسین، 2012). بنابراین، AF ها با مصرف مواد غذایی و خوراک آلوده یا با انتقال AF در آنها، مشکلات سلامتی جدی ایجاد می کنند (Nordkvist et al., 2009; Reiter et al., 2010).
 آفلاتوکسین و سرطان
آفلاتوکسین و سرطان
AFB1، به عنوان یک سرطانزای قوی برای انسان، با عوارض سلامتی جدی همراه است (IARC، 2012). این عامل عاملی برای سرطان کبد و هپاتیت حاد و همچنین شیوع دوره ای آفلاتوککسیکوزیس حاد منجر به مرگ بوده است (Azziz-Baumgartner et al., 2005) همانطور که با آفلاتوکسیکوز کشنده در کنیا گزارش شده است (Probst et al., 2007). AF ها بیشتر در کبد سم زدایی می شوند که دلیل نادر بودن سرطان کبد است. پس از مصرف AFB1، یک سری فرآیندهای متابولیکی آن را به واسطه آنزیم های سیتوکروم P450 به یک واسطه فعال، AFB1-exo-8,9-epoxide تبدیل می کند. واکنش سم زدایی همراه با گلوتاتیون ترانسفرازها (GSTs) رخ می دهد. مکانیسم سم زدایی AFB1-exo-8,9-epoxide ممکن است با مکانیسمی که از سرطان کبد جلوگیری می کند مرتبط باشد، با این حال، هنوز به طور کامل آشکار نشده است (Guengerich et al., 1998).
متأسفانه، از سوی دیگر، آلودگی غذا و خوراک توسط AF یک مشکل دائمی در سراسر جهان است. شیوع بیماری های AF در مناطق گرمسیری و نیمه گرمسیری بیشتر مستعد است و تعداد کمی در مناطق معتدل (مانند غرب میانه ایالات متحده) وجود دارد. علاوه بر این، مناطق مدیترانه ای به دلیل جابجایی در مناطق رخداد سنتی AF به دلیل تغییرات آب و هوایی یعنی افزایش میانگین دما، سطح CO2 و الگوهای بارندگی مستعد آلودگی AF شده اند (Marasas et al., 2008). این منجر به افزایش آلودگی محصولات به قارچ ها و AFs در سراسر جهان شده است.
محصولات تحت تأثیر آفلاتوکسین ها
غلات و محصولات مبتنی بر غلات مواد غذایی اصلی برای مصرف انسان در سراسر جهان هستند (Temba et al., 2017). در بین غلات، برنج و ذرت عمدتاً به دلیل تغییر در شیوه های کشاورزی در شرایط طبیعی به AF آلوده می شوند. AF ها هم در شرایط قبل و هم در شرایط پس از برداشت تولید می شوند (Hesseltine, 1974). فیلازی و سیرلی (2013) گزارش کردند که برنج در مقایسه با سایر غلات بیشتر در معرض آلودگی AF است.
رشد قارچ به دلیل خشک کردن نامناسب دانه های برنج با حفظ رطوبت بالاتر (بیش از 14٪) رخ می دهد. در نتیجه، این قارچ ها باعث تغییر رنگ دانه و/یا پوسته و بدتر شدن کیفیت دانه ها می شوند. از سوی دیگر، بادام زمینی و لوبیا اغلب در بسیاری از رژیم های غذایی آفریقایی برای تکمیل رژیم غلات استفاده می شوند (Soro-Yao et al., 2014).
با این حال، اینها هم در شرایط مزرعه و هم در شرایط ذخیره سازی به شدت مستعد آلودگی AF هستند (Lombard، 2014). میزان رشد قارچ و تولید AF در غلات به دما، رطوبت، نوع خاک و شرایط نگهداری بستگی دارد (Achaglinkame et al., 2017). علاوه بر این، ادویه جات ترشی جات مستعد آلودگی AF هستند و به طور قابل توجهی تحت تأثیر شرایط نگهداری و پردازش قرار می گیرند.
الشفیع و همکاران (2002) آلودگی AF را در طیف گسترده ای از ادویه جات از جمله فلفل سیاه، هل، دارچین، میخک، زیره، گشنیز و زنجبیل در سلطان نشین عمان گزارش کرد. علاوه بر این، Tchana و همکاران. (2010) وجود AFs را در تخمهای جمعآوریشده از یک مزرعه طیور و شیر خام گاو در کامرون گزارش کرد. از این رو، محصولات آسیب دیده به AF اجازه ورود به زنجیره غذایی را می دهند که بسیار تحت تأثیر شرایط آب و هوایی است.
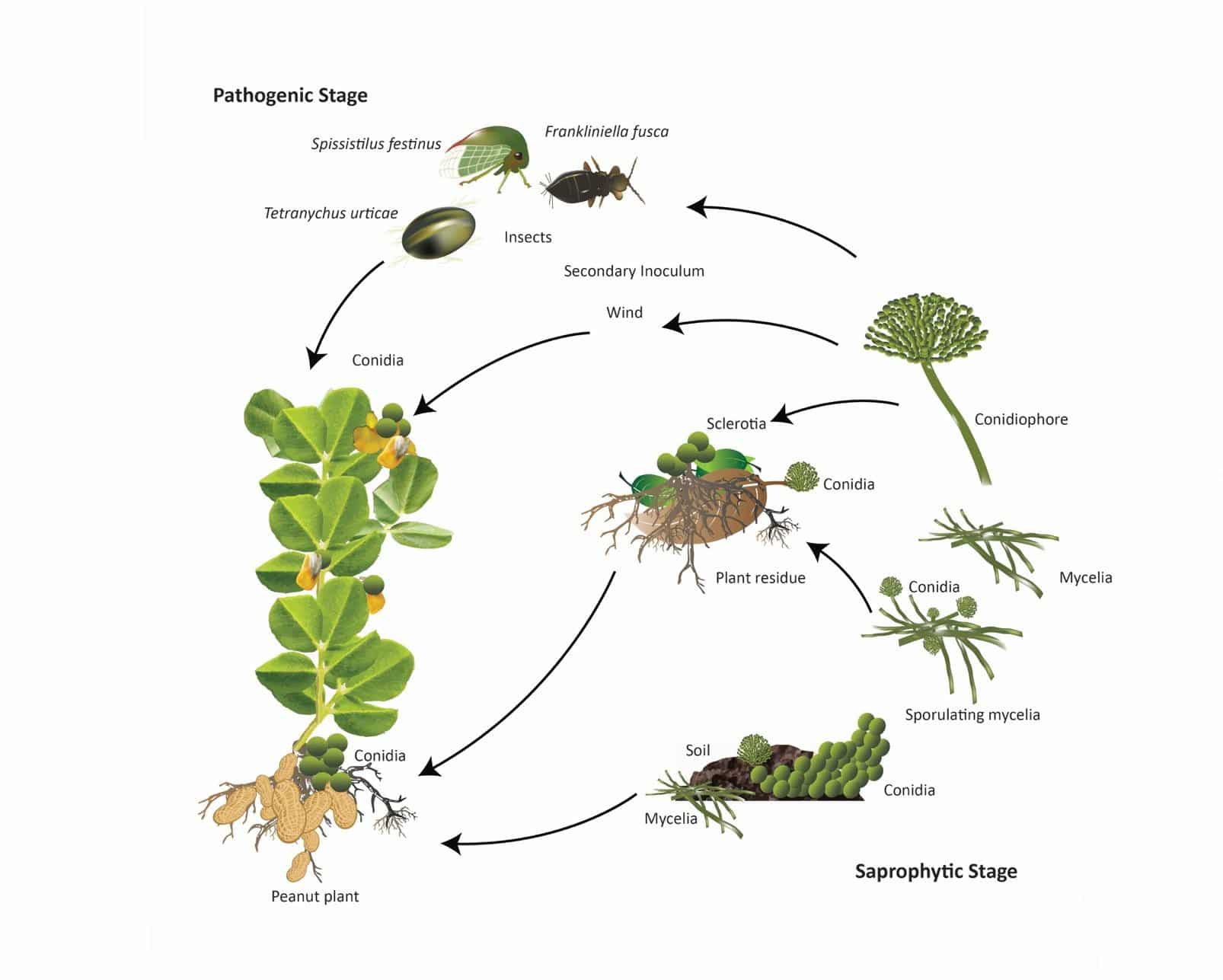 تاثیر تغییر آب و هوا بر تولید آفلاتوکسین
تاثیر تغییر آب و هوا بر تولید آفلاتوکسین
تغییرات آب و هوایی به طور قابل توجهی بر کیفیت و در دسترس بودن غذاهای اصلی برای مصرف تأثیر می گذارد. با افزایش جمعیت در سراسر جهان، تاکید عمده ای بر ایمنی غذا و خوراک شده است که می تواند با محافظت از محصولات در برابر شرایط نامطلوب اقلیمی، تقاضای فزاینده را با افزایش عملکرد برطرف کند (مدینا و همکاران، 2017a). آلودگی آفلاتوکسین ها میلیون ها هکتار از محصولات ذرت و بادام زمینی را در ایالات متحده تحت تاثیر قرار داده است (Robens and Cardwell, 2003).
ذرت یک غذای اصلی برای افرادی است که در آب و هوای گرم در سراسر آسیا، آفریقا و آمریکا زندگی می کنند که مستعد تأثیرات تغییرات آب و هوایی هستند (لوئیس و همکاران، 2005). تغییر آب و هوا به طور همزمان بر جوامع پیچیده قارچ های مولد AF با تغییر تعداد تولیدکنندگان AF برای تغییر ساختار جامعه قارچی آن تأثیر می گذارد. آلودگی آفلاتوکسین از طریق یک مرحله اولیه در طول توسعه محصول و مرحله دوم در طول بلوغ محصول رخ می دهد. آلودگی در بیابان های گرم، مرطوب و حتی گرم و شرایط خشکسالی بیشتر است (کوتی و جیمی-گارسیا، 2007).
مکانیسم های فیزیولوژیکی آفلاتوکسین ها
A. flavus مکانیسم های فیزیولوژیکی بسیار تکامل یافته ای برای سازگاری با شرایط آب و هوایی نامطلوب دارد و بر سایر گونه های قارچی تسلط دارد (Nesci et al., 2004; Magan, 2007). تغییرات آب و هوا باعث تغییر دما و فعالیت آب (aw) در محیط می شود که بر بیان ژن برای تولید AF تأثیر می گذارد. شرایط دما و aw میزان رشد قارچ و تولید AF را تنظیم می کند (اشمیت-هیدت و همکاران، 2009؛ اشمیت-هیدت و همکاران، 2010). ژنهای مولد AF بر روی ژنوم گروهبندی میشوند و ژنهای تنظیمکننده اصلی (aflR؛ aflS)، و همچنین ژنهای ساختاری (aflD) را بیان میکنند که تحت تأثیر تعامل دما × شرایط aw هستند.
همانطور که توسط اشمیت-هایت و همکاران آشکار شد. (2010)، نسبت بیان aflR/aflS به طور قابل توجهی با مقدار AFB1 تولید شده مرتبط است. علاوه بر این، بیان ژن های ناقل قند به طور قابل توجهی تحت تاثیر شرایط دما و aw قرار گرفت (مدینا و همکاران، 2014؛ مدینه و همکاران، 2015). علاوه بر این، برنالدز و همکاران.
(اثر برهمکنش دما و aw را بر بیان ژن تنظیم کننده بیوسنتزی (aflR) و تولید AFB1 توسط A. flavus در ذرت مورد مطالعه قرار داد. آنها رشد بهینه A. flavus را در دمای 30 درجه سانتی گراد / 0.99 aw بدون رشد در 20 درجه سانتی گراد / 0.90 aw مشاهده کردند. هر دو دما و aw بر بیان نسبی ژن aflR و تولید AFB1 تأثیر گذاشتند، با این حال، روند تولید AFB1 مطابق با بیان ژن نبود.
تاثیر دما بر رشد آفلاتوکسین
همچنین اثر دما (20، 27 و 35 درجه سانتیگراد) و aw (82/0، 86/0، 90/0، 94/0 و 98/0) بر رشد A. flavus و A. parasiticus همراه با تولید AFB1 مورد بررسی قرار گرفت. دانه های نایجر آسیاب شده توسط Gizachew و همکاران. (2019). حداکثر تولید AFB1 در 27 درجه سانتی گراد / 0.90 aw برای هر دو A. flavus و A. parasiticus مشاهده شد. علاوه بر این، قارچ ها رشد مطلوبی را روی برنج صیقل داده شده در محدوده 28-37 درجه سانتی گراد / 0.92-0.96 aw نشان دادند.
حداکثر AFB1 در دمای 33 درجه سانتیگراد / 0.96 aw تولید شد (Lv et al., 2019). بر اساس تحقیقات Battilani و همکاران. (2016) در مورد ظهور احتمالی AFB1 در غلات در اتحادیه اروپا در نتیجه تغییرات آب و هوایی، به ازای هر 2 درجه سانتی گراد افزایش دما، افزایش خطر AF در مناطق مختلف اسپانیا، ایتالیا، یونان، پرتغال وجود دارد. بلغارستان، آلبانی، قبرس و ترکیه. به دلیل شرایط آب و هوایی مطلوب برای A. flavus در 30 سال آینده، خطر آلودگی AF در ذرت احتمالاً در اروپا افزایش می یابد (Moretti et al., 2019). بنابراین، روشهای تشخیص مناسب و استراتژیهای کنترل برای مبارزه با مسائل سوزاننده AF در غذا و خوراک بسیار مهم است.
مایکوتوکسین های پوشانده شده به عنوان نگرانی اصلی در تشخیص
مایکوتوکسینهای ماسکدار نگرانی عمدهای در غذا و خوراک ایجاد میکنند، زیرا با تکنیکهای تشخیص معمولاً مورد استفاده شناسایی و شناسایی نمیشوند (Kamle et al., 2019). اینها مایکوتوکسینهایی هستند که توسط قارچها تولید میشوند، اما در طول مراحل عفونت توسط آنزیمهای گیاهی اصلاح میشوند.
آنها در واکوئلها به شکل محلول یا متصل به ماکرومولکولها وجود دارند، بنابراین نمیتوانند با فرآیندهای آنالیز معمول شناسایی شوند و به عنوان مایکوتوکسینهای ماسکدار شناخته شوند (Berthiller et al., 2013). با این حال، AFهای اصلاحشده میتوانند در طول پردازش و/یا فرآیند هضم غذا دوباره به اشکال سمی هیدرولیز شوند (گاریس و همکاران، 1990؛ ناگل و همکاران، 2014؛ بروکارت و همکاران، 2015). برخی از این سموم اصلاح شده در اشکال مختلف به عنوان کمپلکس با ترکیبات ماتریکس وجود دارند، از این رو به عنوان مایکوتوکسین های مرتبط با ماتریکس نیز شناخته می شوند (Rychlik et al., 2014). گزارش شده است که مایکوتوکسین های ماسک دار در آسیا، آفریقا، آمریکا و اروپا وجود دارند.
بنابراین، مقدار بالایی از مایکوتوکسینهای ماسکدار موجود در غذاها و خوراکهای مختلف میتواند مشکلات جدی برای سلامتی انسان و حیوانات ایجاد کند (ژانگ و همکاران، 2019). بنابراین، تشخیص مایکوتوکسینهای ماسکدار یک بخش ضروری برای اطمینان از ایمنی غذا و خوراک است. فومونیزینهای ماسکدار از طریق هیدرولیز تعیین شدند که در آن اشکال اصلاحشده دوباره به فرمهای آزاد خود تبدیل شدند و متعاقباً از طریق LC/MS/MS آنالیز و شناسایی شدند (Dall’Asta و همکاران، 2008؛ Dall’Asta و همکاران، 2009). فرآیند هیدرولیتیک ممکن است شامل تیمارهای قلیایی، اسیدی یا آنزیمی باشد (Dall’Asta و همکاران، 2009؛ Beloglazova و همکاران، 2013؛ ویدال و همکاران، 2018).
با این حال، اطلاعات کمتری در مورد AF های ماسک دار در دسترس است، زیرا بیشتر اولویت ها برای تشخیص AF های رایگان در مواد غذایی و خوراک کشاورزی است. بنابراین، روشهایی مانند هضم آزمایشگاهی و هیدرولیز، همانطور که در مورد فومونیزینهای ماسکدار اعمال میشود، میتواند برای AFهای ماسکدار در غذا و خوراک و پس از شناسایی با LC/MS/MS و تایید با روشهای دیگر مانند ELISA برای اطمینان از ایمنی غذا و خوراک انجام شود.
استراتژی های کنترل آفلاتوکسین ها
اجرای فناوری های پیشرفته کشاورزی، شیوه های خوب کشاورزی (GAPs)، شیوه های تولید خوب (GMPs) و شیوه های ذخیره سازی خوب (GSPs) می تواند آلودگی مایکوتوکسین ها را کاهش دهد (Kamle et al., 2019). تکنیکهای پردازش جدید شامل مایکروویو، UV، نور پالسی، آب الکترولیز شده، پلاسمای سرد، ازن، پرتو الکترونی و تابش گاما (γ) پتانسیل مدیریت AF و حفظ و حفظ کیفیت محصولات کشاورزی و غذایی را دارند (جلیلی و همکاران همکاران، 2010؛ پانکاج و همکاران، 2018). کاربرد ازن با یک حمله الکتروفیلیک به کربنهای با پیوند دوگانه (C8-C9) حلقه فوران، AF را تجزیه میکند که منجر به تشکیل ازنیدهای اولیه و به دنبال آن بازآرایی به مشتقات مونوزونید مانند آلدئیدها، کتونها و اسیدهای آلی میشود (جلیلی، 2016).
علاوه بر این، مکانیسم دقیق تخریب ازن AFB1 توسط دیائو و همکاران مورد بحث قرار گرفته است. (2013). استفاده از ازن برای تخریب AF در محصولات غذایی به دلیل فاکتور هزینه محدود است (Womack et al., 2014). به طور مشابه، مکانیسم تخریب AF توسط پرتوهای گاما بر روی اثرات رادیکالهای آزاد تولید شده در طول تجزیه رادیویی آب و سایر اجزایی است که به حلقه فوران انتهایی AFB1 حمله میکند و منجر به تولید محصولات جانبی کاهش فعالیت بیولوژیکی میشود (Rustom، 1997). راندمان تخریب تابش گاما زمانی موثرتر است که با سایر فناوری ها ترکیب شود.
علاوه بر اینها، چندین افزودنی خوراکی مصنوعی و طبیعی برای کاهش AF در غذا و خوراک مورد مطالعه قرار گرفته است. به عنوان مثال، استفاده از اسید سیتریک در ترکیب با رطوبت در دمای بالا (200 درجه سانتی گراد) و فشار (8N) در تجزیه AF در سورگوم اکسترود شده موثر بود (Méndez-Albores et al., 2009). از سوی دیگر، کارایی هیدروسولفیت سدیم (Na2S2O4) با افزایش فشار برای کاهش AF در فلفل سیاه افزایش یافت (جلیلی و جیناپ، 2012). علاوه بر این، به عنوان بخشی از اقدامات کنترل بیولوژیکی، Anjaiah و همکاران.
(2006) گزارش کردند که تلقیح سویه های آنتاگونیست سودوموناس، باسیلوس و تریکودرما گونه ها. کاهش قابل توجهی از A. flavus در محصولات قبل از برداشت بود. سویه های غیر تشکیل دهنده آفلاتوکسین A. flavus و سایر کپک های غیر سمی عوامل کنترل بیولوژیکی برجسته در برابر آلودگی AF هستند (Dorner et al., 2003; Udomkun et al., 2017). استفاده از هر تکنیک مزایا و معایب خود را دارد. بنابراین، اقدامات کنترل زیستی همزمان با سایر روشهای فیزیکی و شیمیایی به همراه مواد بستهبندی بهبود یافته باید برای دستیابی به ایمنی و امنیت غذایی اجرا شود.
نتیجه
آلودگی آفلاتوکسینهای محصولات در شرایط قبل و بعد از برداشت را میتوان تا حدی با اجرای شیوههای کشاورزی خوب (GAPs)، شیوههای تولید خوب (GMPs) و شیوههای نگهداری خوب (GSPs) کنترل کرد. علاوه بر این، فناوریهای جدید پردازش شامل مایکروویو، UV، نور پالسی، آب الکترولیز شده، پلاسمای سرد، ازن، پرتو الکترونی یا تابش گاما (γ) در ترکیب با روشهای مهندسی بیولوژیکی، فیزیکی، شیمیایی یا ژنتیک، پتانسیل بهبود راندمان ضدعفونی AF و همچنین غلبه بر محدودیت های هر فناوری خاص.
با این حال، درک مکانیسمهای سمزدایی AF بسیار حیاتی است تا زمانی که این روشها در نمونههای غذا و خوراک استفاده میشوند، هیچ باقیمانده AF باقی نماند. علاوه بر این، از آنجایی که اطلاعات کمتری در مورد AFهای ماسکدار موجود در غذا و خوراک وجود دارد، به تحقیق و درک عمیق در رابطه با هیدرولیز، شناسایی، شناسایی و استراتژیهای کنترل کافی نیاز دارد. بنابراین، استفاده از فنآوریهای جدید همراه با افزایش آگاهی عمومی برای اجرای GAPs، GMPs و GSPs برای کنترل آلودگی AF در غذا و خوراک برای تضمین ایمنی و امنیت غذایی و حفظ سلامت انسان و حیوانات بسیار مهم است.
 مقدمه ای بر سموم آفلاتوکسین
مقدمه ای بر سموم آفلاتوکسین تاثیر آفلاتوکسین بر حیوانات و انسانها
تاثیر آفلاتوکسین بر حیوانات و انسانها






